É o que você procurava?
Fale conosco para obter o trabalho completo, clique no botão ao lado
Considere que você foi contratado por uma indústria farmacêutica que produz diversas substâncias líquidas. Sua primeira atribuição na empresa é determinar o calor específico de um líquido X. Aquecer essa substância e medir sua variação de temperatura seria uma forma de medir esse calor específico, mas qual seria a quantidade de calor absorvida? É muito difícil dizer. Para contornar esse problema, você poderia usar o princípio de que corpos isolados trocam calor até entrarem em equilíbrio térmico. Neste caso, supondo que não há mudança de fase envolvida, temos.
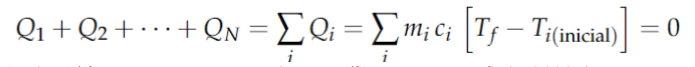
Com isso, só fazemos menção as massas, calores específicos e temperaturas finais e iniciais dos corpos envolvidos. Contudo, isso traz outro problema. Precisaríamos saber o calor específico ou capacidade térmica C = m*c da outra substância com quem X está trocando calor. Para contornar este problema, os cientistas escolheram uma substância para definir seu calor específico, a água, cujo valor é definido como c = 1 cal/gºC. Dessa forma, poderíamos usar a água como referência para medir o calor específico do líquido X. Antes disso, precisamos contornar um problema prático: Quando colocamos um líquido dentro de um recipiente ele troca calor com este recipiente. Então, ao juntarmos o líquido X e água temos que levar em consideração o recipiente em que eles estão. Isso coloca mais uma variável no nosso problema: A capacidade térmica do recipiente. Faremos, então, o seguinte: Usaremos a água como referência para determinar a capacidade térmica do recipiente. Depois, usaremos o recipiente e o líquido X para determinar o calor específico c de X.
Parte 1: a) Seja um calorímetro (recipiente do enunciado) de capacidade térmica desconhecida C a uma temperatura inicial de T. Suponha que aqueçamos uma massa m de água até a temperatura T. Depositamos a água no calorímetro e medimos a temperatura final do sistema T após o equilíbrio térmico ser atingido. Mostre que a capacidade térmica do calorímetro é determinada por
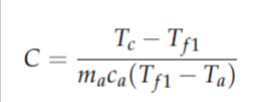
b) Faremos agora o mesmo procedimento, mas trocando a água pelo líquido X. Mostre que o calor específico $c_X$ do líquido X é determinado por:
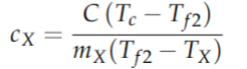
Parte 2: Após entender bem a parte teórica sobre como determinar o calor específico de um líquido, você deve colocar esse conhecimento em prática. Realize o experimento virtual nos simuladores da ALGETEC chamado de Calorimetria (https://unicesumar.grupoa.education/marketplace/ua/5fc79b67f30b4e00189c91ce). Indique em uma tabela os valores medidos das temperaturas e das massas em cada etapa do experimento separadamente e anexe os resultados na atividade.
Parte 3: Agora é hora de combinar os resultados obtidos experimentalmente junto aos cálculos teóricos. Use os dados obtidos na parte 2 para determinar a capacidade térmica do calorímetro e o calor específico da substância que você usou no experimento. Com os resultados em mãos, discuta quais são as principais fontes de erros experimental que podem interferir no resultado final.
#mapa #unicesumar #módulo 52 #fisica geral #fisica experimental #industria farmaceutica #substancias liquidas #corpos isolados #temperaturas finais #capacidade termica #experimento virtual #fonte de erros
É o que você procurava?
Fale conosco para obter o trabalho completo, clique no botão ao lado
Trabalhos Relacionados:

Você já saiu com sua família, amigos ou colegas do trabalho e achou injusta a forma como dividiram a conta? Quando consumimos produtos ou serviços diferentes, é comum sentir que a divisão equitativa da conta não é justa para todos.
MAPA – PIND – CUSTOS DE PRODUÇÃO – 53_2024 Você já saiu com sua família, […]

MAPA – PIND – CUSTOS DE PRODUÇÃO – 53_2024
CONTEXTUALIZAÇÃO – Custeio Departamental Você já saiu com sua família, amigos ou colegas do trabalho […]

Analisando o processo produtivo da empresa Sossego do Vale Ltda., você levantou que a produção acontece em duas linhas, do produto A e do produto B. Esses produtos não passam necessariamente pelo mesmo número de processos, logo seus custos com mão de obra direta também não são os mesmos
ATIVIDADE 1 – PIND – CUSTOS DE PRODUÇÃO – 53_2024 Analisando o processo produtivo da […]

Deixe um comentário